研究者发起临床研究的运行管理标准操作规程
时间:2024年01月24日信息来源:本站原创
研究者发起的临床研究(Investigator Initialed Trial,IIT)是指研究者运用已上市药品、医疗器械、诊断试剂等开展的临床研究。该类研究以人体/ 患者为观察对象,涉及病因、预防、诊断、治疗、预后及康复等探索。通常由本院在岗医务人员发起,也可以与企业、协会或院外单位联合发起。
参照《药物临床试验质量管理规范》及ICH-GCP 要求,国内、外临床研究的规范和要求,结合我院的具体情况,规范 IIT 的实施。临床研究部对 IIT 实行分类、分级管理(临床研究分类请参照附录一)。主要研究者(PI)参照《PI 工作指引》开展临床研究工作。
1.立项准备
1.1 研究方案的设计。
主要研究者(Principal Investigator, PI)负责研究方案和研究主要文件的制定,应邀请统计/流行病专家参与(如 5010 项目/308 计划等)或咨询;研究方案的撰写可参照国内外公认的设计规范或本院的“临床研究方案拟定指引”。
1.2 研究团队的组建。
PI根据项目的具体情况组织研究小组,研究团队中医护人员、可能接触受试者的相关人员均需接受相关GCP培训,并获得证书。
1.3 研究者会议的召开。
由我中心发起的多中心临床研究建议召开研究者会议,收集各参加中心对方案和实施可行性的建议和意见。临床研究部办公室视情况派人参会。
1.4 立项资料的提交。
1.4.1 研究相关文件定稿后,PI/CRC 按照(附件1) 准备资料,提交到机构办。其中(附件2、附件3、PI简历需签字上交原件)。
1.4.2 资料的形式审查。GCP办公室秘书进行形式审查,审查合格后给予“机构受理号”。
1.4.3 纸质资料的上交。待形式审查通过后,在附件4中填写好“机构受理号 ”,递交纸质版材料1套至伦理办公室,供上会讨论。
1.4.4 其他注意事项:
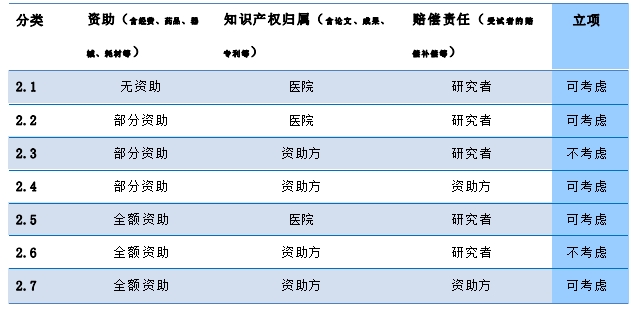
1.4.4.1 研究者首先根据[附录一]中研究类型“分类 2 ”就资助情况、知识产权和受试者赔偿/补偿等在研究方案、研究合同中予以明确;
1.4.4.2 如参加其他单位的多中心临床研究,研究者应提交组长单位的伦理批件和经伦理批准的研究方案和知情同意书。
1.4.4.3 如需申请协会/学会资助的临床研究项目,需要医院/中心签章的,应到临床研究部办公室办理相关手续;待项目获得资助后,应按流程进行正式立项。
1.4.4.4 对风险高或经费大的跨院校/科室临床研究,应得到PI所在科室主任签字同意。
1.4.4.5 对于信息调研类的研究,涉及用药/诊疗信息和医疗费用等敏感信息的,需由医务处审定。
1.4.4.6 涉及大型医疗设备的IIT项目,应首先得到PI所在科室主任签字同意,同时要提交总务处和医务处审定其可行性。
2.立项审核
GCP办公室按照《立项审核的 SOP》进行最终结果审查。
3.伦理审核
3.1 研究者按照伦理委员会的要求准备材料 ,登录“临床研究管理平台”将申报材料进行伦理递交,同时递交纸质版材料到伦理办公室。
3.2 最终的“伦理委员会审批件”由研究者保存在该项目的研究文件夹中。
4.合同审核
4.1 临床研究部同意立项后,PI/CRC 按照《临床试验合同签订的 SOP》与资助方和分中心拟订合同条款及协商经费预算,在“临床研究管理平台”提交初步定稿的合同/协议。
4.2 合同审核通过后,由GCP办公室秘书交院长或被授权人签字生效。
4.3 合同正式签署后,方能开展临床研究。
4.4 如项目立项时无任何经费资助,PI需签署“无任何经费资助的声明 ”( 附件5)。如在实施过程中,获得经费资助,PI应按《临床试验合同签订的 SOP》 办理相关事宜。
5.“人遗办 ”批件申请立项后,如需申请“人遗办 ”审批的项目,PI/CRC 应向机构办公室提出申请,参照《人遗办申请工作指引》办理。
6.项目实施
6.1 研究资料的准备
启动会召开前,PI/CRC 应确保临床研究资料准备妥当。
6.2 研究药品、器械等的准备
启动会召开前,研究药品、器械等提供者将相关物资交于研究小组。PI/CRC参照《药物管理制度》《药物的接收、保存、分发、回收、退还、销毁的 SOP》,派专人负责物资的接收、保管、分发、回收和退还。
6.3 启动会的召开。
PI参照《药物临床试验项目启动的 SOP》主持召开项目启动会。
6.4 各方责任的界定。
项目管理实施PI负责制,PI对受试者权益、医疗安全负全责,对研究数据的真实性负全责及直接责任;所在科室负责人及临床研究部负有管理责任、属于间接责任人。
6.5 分工及授权。
参与的研究人员,其行使职责应符合各自执业范围及授权内容。涉及知情同意、医疗判断、医嘱等环节,须由本院注册、经PI授权的临床医生负责执行;临床研究相关医疗病历、文书的书写,需由PI授权的临床医生签名确认。研究人员参照中国相关GCP及ICH-GCP、研究方案及相关SOP实施临床研究(如《受试者知情同意的SOP》《原始资料记录的 SOP》《病例报告表填写的SOP》《不良事件及严重不良事件处理与记录的SOP》《药物临床试验SAE报告的 SOP》等)。
6.6 SAE 的上报。
在研究过程中,若发生不良事件,研究者按照方案和医院相关规定积极处理,如为严重不良事件应及时报告伦理委员会;已上市药品按《药品不良反应报告和监测管理办法》的要求,报告本院不良反应监测中心(药剂科临床药学室);已上市医疗器械按《药品不良反应报告和监测管理办法》《医疗器械监督管理条例》的要求,报告本院医务处相关负责人。
7.质量管理
7.1 研究者应制定相应的项目SOP以保障研究项目的规范实施;
7.2 如我中心为组长单位,PI应对各中心的研究质量进行必要的监管;
7.3 如研究项目有多方参与或有资助方,应按照合同的约定处理各方的责权及受试者损害的赔偿/补偿。
7.4 临床研究部质量管理员视具体情况对研究项目质量和进度进行检查,对存在的问题发出“问题通告书”,研究者予以整改并书面回复;存在严重问题的,必要时发出“警告信”;对违背 GCP 和方案并造成严重后果者,遵照《临床研究缺陷管理制度》由相关部门进行处理。
7.5 项目执行过程中,研究者应积极配合各类稽查或检查,对存在的问题及时整改。
8.资料保存/总结/发表
8.1 项目结束后,参照机构《档案管理制度》,由 PI/CRC 负责研究资料的整理,自行保存。
8.2 临床研究总结报告如需GCP办公室签章,PI应对总结报告的真实性和科学性负责,确认签名后交至GCP办公室秘书,由GCP主任审阅后盖“GCP办公室”章。
8.3 PI 在 发 表 论 文 之 前 应 将 研 究 数 据 在 RDD 平 台 上 备 案,具体可参照《关于研究论文需要备案研究数据的通知(肿瘤防治(2017)45 号)》。
附录一:各类临床研究的范畴及分类
第一类:注册类临床试验
1. 根据药监管理部门的管理分类
1.1 药物临床试验:分为 I 期、II 期、III 期和 IV 期
1.2 医疗器械临床试验
1.3 体外诊断试剂临床试验
第二类:研究者发起的临床研究
2. 按照资助情况、知识产权归属以及受试者损害赔偿责任分类:
资助来源包括:药企、基金会、学会/协会(如中华医学会、中国抗癌协会、吴阶平基金等)、私人捐赠等。如资助来源为本校或其他医院等,另行考虑。
3. 按照研究设计类型分类:
3.1 干预性研究(Interventional study)
3.2 诊断性研究(Diagnostic study)
3.3 观察性研究(Observational study)
4. 按照适应症范围分类:
4.1 适应症范围内:研究用药品严格按说明书使用,不涉及改变说明书适应症剂量、给药途径、给药方式、时间等。
4.2 增加适应症研究:肿瘤专业开展此类研究应为肿瘤领域新适应症的探索性研究。如:增加新瘤种;增加新给药方案;增加早期或晚期用药;增加三/二/ 一线用药;增加单药或联合用药;增加儿童用药或成人用药。(可参考:CFDA 2012年颁布的《已上市抗肿瘤药物增加新适应症技术指导原则》)已经上市的抗肿瘤药物增加非肿瘤领域新适应症的申请,属于注册类研究!
5. 按照研究风险分类:
5.1 高风险研究:干预措施为超适应症范围的药物,新术式或创伤性检查等;
儿童、青少年和高龄患者(>65 岁)为研究对象的研究;
5.2 中等风险研究:介于高风险与低风险的研究
5.3 低风险研究:观察性研究。